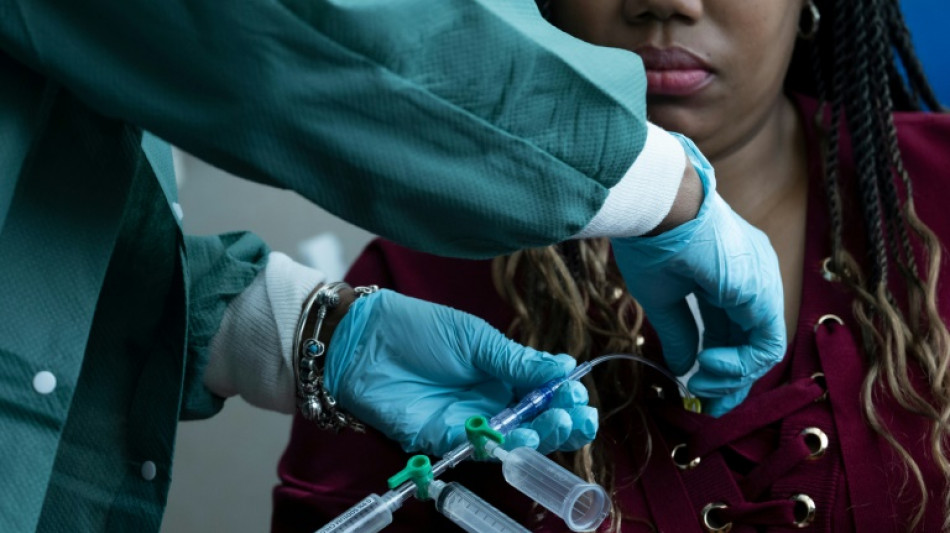

Cómo la terapia genética cambió la vida de pacientes con drepanocitosis
Sus historias se dividen entre un antes y un después de haber recibido un tratamiento. Primero, largos años de enfermedad, a menudo muy dolorosa. Finalmente, una vida sin drepanocitosis.
Dos estadounidenses que padecen esta enfermedad de la sangre contaron a la AFP su recorrido entre una etapa y otra.
Ambos quieren dar a conocer las innovadoras terapias genéticas que acaban de ser autorizadas en Estados Unidos, aunque todavía su costo exorbitante (hasta 3,1 millones de dólares por persona) las hace prohibitivas para la mayoría.
- Prejuicio -
Tesha Samuels nació en 1982, justo antes del inicio de pruebas de detección de la drepanocitosis, una enfermedad genética que afecta a unas 100.000 personas en Estados Unidos y a 20 millones en el mundo.
La mayoría de quienes la contraen son negros, lo que se debería, según los científicos, a que esas células evolucionaron para proteger del paludismo.
Los pacientes con drepanocitosis presentan una mutación que afecta la hemoglobina, una proteína de los glóbulos rojos que transporta oxígeno. La mutación hace que los glóbulos rojos adopten forma de hoz, dificultando el flujo sanguíneo y el suministro de oxígeno.
Las consecuencias pueden ser dramáticas: anemia, dolores agudos, daño a órganos, muerte prematura.
Tesha Samuels fue diagnosticada a los dos años. A los siete sufrió un ataque de anemia y a los 13 un derrame cerebral que la obligó a recibir transfusiones de sangre mensualmente.
Según ella, el "prejuicio sobre los niños negros que van al hospital a decir que se sienten mal" la hizo esperar tanto que las cosas degeneraron.
Estudiaba medicina en la prestigiosa Universidad de Howard, pero debió abandonar debido a su enfermedad: necesitaba ocho horas de transfusiones cada noche.
- "Volver a vivir" -
En 2018, su vida dio un vuelco: se convirtió en una de las primeras personas en recibir un tratamiento que entonces estaba en fase experimental.
Comercializado como Lyfgenia, la terapia utiliza un virus inofensivo para llevar a las células una versión saludable del gen que produce la hemoglobina.
Los médicos primero recolectan las células madre del paciente y luego una quimioterapia elimina las células madre de la médula espinal, que son reemplazadas por las células modificadas.
Samuels perdió el cabello y fue hospitalizada por una hemorragia nasal que duró 16 horas. Sus plaquetas tardaron meses en volver a la normalidad. Luego recuperó su energía. "Es como volver a vivir", comenta ahora.
Retomó sus estudios, se diplomó y creó una organización, "Journey to ExSCellence", para difundir el tratamiento entre la población afroestadounidense.
Como Samuels, cada paciente que participó en el ensayo clínico tendrá seguimiento durante 15 años.
- Una larga lucha -
El primer recuerdo que Jimi Olaghere, hoy de 38 años, tiene de su enfermedad remonta a cuando tenía ocho y en su Nigeria natal debía parar cada cinco minutos para descansar e hidratarse al jugar al fútbol.
Sus padres lo enviaron a vivir a Estados Unidos, donde la atención médica era mejor, pero su infancia siguió siendo dramática.
No logró completar sus estudios, debieron extirparle la vesícula biliar y sufrió un infarto. A veces pasaba 80% del tiempo en cama.
En 2019 supo de un ensayo clínico que utilizaba las tijeras moleculares Crispr. Se inscribió, fue aceptado, y ahora, gracias a las células madre modificadas que recibió con este tratamiento, llamado Casgevy, está "viviendo un sueño". Se casó, tuvo tres hijos y administra varios comercios.
También él quiere popularizar esta terapia, sobre todo en África.
Para John Tisdale, de los Institutos de Salud de Estados Unidos (NIH), a cargo del ensayo en el que participó Samuels, el siguiente paso es hacer que el tratamiento sea menos oneroso.
Medicaid, el programa de salud pública de Estados Unidos, anunció que a partir de 2025 lo cubrirá, pero todavía hay incertidumbre respecto a los seguros privados.
P.MacNair--NG